邢其毅《基础有机化学》(第4版)课后习题详解 【完整内容点击文中链接获取】
习题1-1 写出符合下列分子式的链形化合物的同分异构体。
(i)C4H10 (ii)C5H10
解:(i)分子式C4H10完全符合链形烷烃的通式CnH2n+2,为饱和烃。若只考虑链形结构,则其对应的同分异构体共有2个,结构简式如下:
(1)CH3CH2CH2CH3 (2)CH3CH(CH3)CH3
(ii)分子式C5H10完全符合链形烷烃的通式CnH2n,为不饱和烃。若只考虑链形结构,仅需考虑烯烃类有机物,分析链形异构时也要考虑烯烃的顺反异构。故其对应的同分异构体共有6个,结构简式如下:
(1)CH3CH2CH2CH=CH2 (2)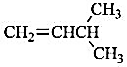
(3)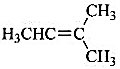 (4)
(4)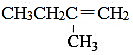
(5)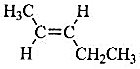 (6)
(6)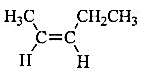
习题1-2 用伞形式表达下列化合物的两个立体异构体。
(i)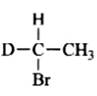 (ii)
(ii)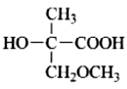 (iii)
(iii)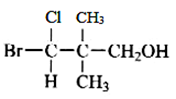
解:题中每一个化合物分子中均含有一个手性碳原子,因此每个化合物均有两个立体异构体,分别是本身和其对映体。
(i)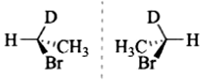
(ii)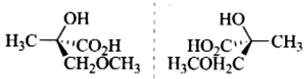
(iii)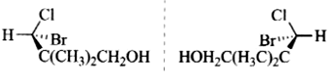
习题1-3 写出下列分子或离子的一个可能的Lewis结构式,如有孤对电子,请用黑点标明。
(i)H2SO4 (ii)CH3CH3 (iii)+CH3 (iv)NH3
(v)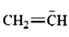 (vi)
(vi)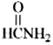 (vii)H2NCH2COOH
(vii)H2NCH2COOH
解:对于Lewis结构式,常用短线表示成键电子,孤电子对用黑点表示。故各分子或离子的Lewis结构式如下所示:
(i)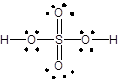 (ii)
(ii)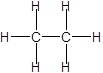 (iii)
(iii)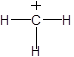 (iv)
(iv)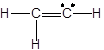
(v)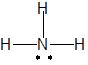 (vi)
(vi)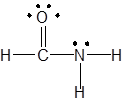 (vii)
(vii)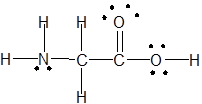
| 内容来源 |
邢其毅《基础有机化学》(第4版)课后习题详解  |
习题1-4 根据八隅规则,在下列结构式上用黑点标明所有的孤对电子。
(i)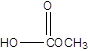 (ii)
(ii)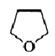 (iii)
(iii)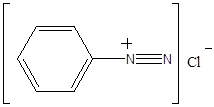
解:根据八隅规则,题中各化合物的孤对电子如下所示:
(i)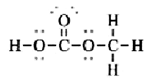 (ii)
(ii)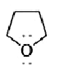 (iii)
(iii)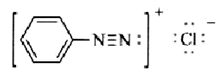
习题1-5 下列化合物中,哪些是离子化合物?哪些是极性化合物?哪些是非极性化合物?
NaCl;Cl2;CH4;CH3Cl;CH3OH;CH3CH3;LiBr
解:含有离子键的化合物称为离子化合物;具有偶极矩的共价化合物为极性化合物,正负电荷中心重叠的共价化合物为非极性化合物,如双原子分子、结构对称的分子等。上述化合物按题意分类如下所示:
离子化合物有:KBr;极性化合物有:CH3Br、CH3OH;非极性化合物有:I2、CH3CH3。
习题1-6 结合教材表1-3中的数据回答下列问题:
(i)下列化合物中,编号所指三根C—H键的键长是否相等?为什么?
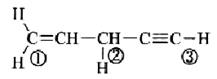
(ii)下列化合物中,编号所指碳碳键的键长是否相等?为什么?
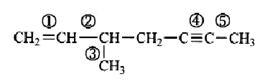
(iii)卤甲烷中,碳氟键与碳碘键的键长为什么不同?
(iv)氯甲烷和氯乙烷中,碳氯键的键长是否相等?为什么?
解:(i)箭头所指三根C—H键的键长不相等。因为C的杂化轨道方式不同,则对电子的吸引力就不同。杂化轨道中s成分的含量越多,该碳原子的电负性就越大。电负性大的碳原子对电子的吸引强,最终导致相应的C—H键键长会短一些。因此三根键键长的大小顺序为:②>①>③。
(ii)箭头所指五根C—C键的键长不相等。通常情况下,单键最长,双键次之,三键最短。①是碳碳双键,由一根Csp2—Csp2σ键和一根Cp—Cpπ键构成。④是碳碳三键,有一根Csp—Cspσ键和两根Cp—Cpπ键构成。②③⑤均为碳碳单键,但碳原子的杂化方式不同,即②为Csp3—Csp2σ键,③为Csp3—Csp3σ键,⑤为Csp3—Cspσ键。由于杂化轨轨道不同,不同的C对电子的吸引力也不相同。杂化轨道中s成分的含量越多,该碳原子的电负性就越大,键长就越短。故这五根键的键长顺序为③>②>⑤>①>④。
(iii)不同的卤甲烷中,因卤原子的电负性不同,电负性越大,对电子的吸引能力越强,导致碳卤键键长越短;卤原子半径越大,导致碳卤键的半径越长。I的电负性比F小,且原子半径比F大,所以碳氟键与碳碘键的键长不同,而且碳碘键的键长长于碳氟键。
(iv)不相等。与卤原子相连的中心碳原子周围的电子云环境不同,则会导致碳卤键的键长不相同。氯乙烷存在一根C—CH3,由于甲基具有给电子效应,使得C—Cl键具有更大的极性,最终导致中心碳原子和氯原子之间的距离更近。所以氯乙烷的碳氯键要比氯甲烷更短。
……
【完整版】 达聪网 邢其毅《基础有机化学》(第4版)(上册)课后习题和考研真题详解
热门内容
邢其毅《基础有机化学》(第4版)(下册)课后习题和考研真题详解
有机化学考研题库【考研真题精选+章节题库】
有机化学(2小时学完)期末速成课