第一章 气体和溶液
1有多个用氦气填充的气象探测气球,在使用过程中,气球中氦的物质的量保持不变,它们的初始状态和最终状态的实验数据如下表所示。试通过计算确定表中空位所对应的物理量,以及由(2)的始态求得M(He)和(3)的始态条件下ρ(He)。
表1-2-1 初始态及最终态实验数据
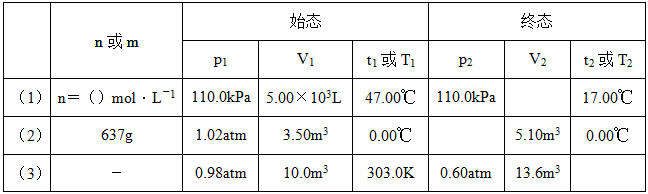
解:(1)根据题意可知,p1=p2=110.0kPa,V1=5.00×103L,T1=273.15+47=320.15K,T2=17+273.15=290.15K。
由于n,p恒定,V1/V2=T1/T2,因此
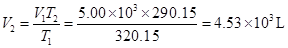
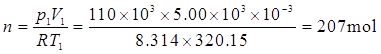
(2)已知p1=1.02atm×101.325kPa/(1atm)=103.4kPa,V1=3.5×103L,V2=5.10×103L,T1=T2=273.15K。
由于n,T恒定,p1V1=p2V2,因此
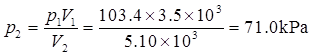
因为M=mRT/(ρV),所以
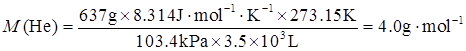
(3)已知p1=101.325kPa×0.98=99.30kPa,V1=104L,T1=303K,p2=60.80kPa,V2=1.36×104L。
由于n一定,p1V1/T1=p2V2/T2,因此
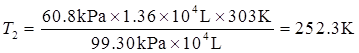
因为pV=nRT,m=ρV,n=m/M,所以
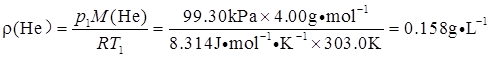
2某气体化合物是氮的氧化物,其中含氮的质量分数以ω(N)=30.5%;某一容器中充有该氮氧化物的质量是4.107g,其体积为0.500L,压力为202.65kPa,温度为0℃。试求:
(1)在标准状况下,该气体的密度。
(2)该氧化物的相对分子质量Mr和化学式。
解:(1)根据Boyle定律可知,标准状况下的气体体积为
V=202.65kPa×0.500L/(101.32kPa)=1.00L
由密度的定义,可得ρ=m/V=4.107g/(1L)=4.107g·L-1。
(2)该气体的物质的量为n=pV/(RT)=202.65kPa×0.5L/(8.314J·mol-1·K-1×273.15K)=0.0446mol。
该气体的摩尔质量为Mr=m/n=4.107g/(0.0446)mol=92.1g·mol-1。
则氮的原子数为(N)=92.1×30.5%/14=2。
氧的原子数为(O)=92.1×(1-30.5%)/16=4。
所以该气体的化学式为N2O4。
3、在0.237g某碳氢化合物中,其ω(C)=80.0%,ω(H)=20.0%。22℃,756.8mmHg下,体积为191.7mL。确定该化合物的化学式。
解:该化合物的物质的量为
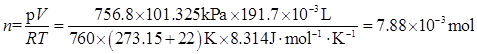
碳的物质的量为n(C)=mω(C)/[M(C)]=0.237g×0.8/(12g·mol-1)=0.0158mol。
氢的物质的量为n(H)=mω(H)/[M(H)]=0.237g×0.2/(1g·mol-1)=0.0474mol。
则碳的数目为(C)=n(C)/n=0.0158/(7.88×10-3)=2。
氢的数目为(H)=n(H)/n=0.0474/(7.88×10-3)=6。
所以此化合物的化学式为C2H6。
4、在容积为50.0L的容器中,充有140.0g的CO和20.0g的H2,温度为300K。试计算:
(1)CO与H2的分压。
(2)混合气体的总压。
解:(1)两气体的分压与其物质的量成正比,所以只要计算其物质的量即可计算出分压。
n(CO)=m(CO)/[M(CO)]=140.0g/(28.0g·mol-1)=5.0mol
n(H2)=m(H2)/[M(H2)]=20.0g/(2.0g·mol-1)=10.0mol
p(CO)=n(CO)RT/V=5.0mol×8.314J·mol-1·K-1×300K/(50.0L)=249kPa
p(H2)=n(H2)RT/V=10mol×8.314J·mol-1·K-1×300K/(50.0L)=499kPa
(2)由气体的分压定律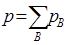 ,可得
,可得
p=p(CO)+P(H2)=249kPa+499kPa=748kPa
5在激光放电池中的气体是由2.0mol CO2,1.0mol N2和16.0mol He组成的混合物,总压为0.30MPa。计算各组分分压。
解:气体总的物质的量为n=2.0mol+1.0mol+16.0mol=19.0mol。
根据分压定律,气体的分压与其物质的量成正比,所以pB=p×nB/n,则
p(CO2)=0.0316MPa;p(N2)=0.0158MPa;p(He)=0.2526MPa。
……
【完整版】 达聪网 大连理工大学无机化学教研室《无机化学》(第6版)笔记和课后习题(含考研真题)详解
热门内容
大连理工大学无机化学教研室《无机化学》(第6版)配套题库【考研真题精选+章节题库】(上册)




 大连理工大学无机化学教研室《无机化学》(第6版)笔记和课后习题(含考研真题)详解
大连理工大学无机化学教研室《无机化学》(第6版)笔记和课后习题(含考研真题)详解 


