天津大学物理化学教研室《物理化学》(第6版)上册课后答案详解 【完整内容点击文中链接获取】
第1章 气体的pVT关系
1-1 物质的体膨胀系数αV与等温压缩率κT的定义分别为αV=(∂V/∂T)p/V,κT=-(∂V/∂P)T/V。
试导出理想气体的αV、κT与温度、压力的关系。
解:由理想气体状态方程:pV=nRT,分别做如下微分
(∂V/∂T)p=nR/p;(∂V/∂p)T=-nRT/p2=-V/p
可得
αV=(∂V/∂T)p/V=(1/V)·nR/p=1/T
κT=-(∂V/∂T)T/V=(-1/V)·(-V/p)=1/p
1-2 体积为200dm3的气瓶中装有27℃、101.325kPa的CO2气体,求该气体的质量(设此气体可视为理想气体)。
解:根据理想气体状态方程pV=nRT得
n=pV/(RT)={(101.325×103×200×10-3)/[8.314×(273.15+27)]}mol=8.12mol
故该气体的质量为m=nM=8.12×44.008×10-3kg=0.357kg
1-3 0℃、101.325kPa的条件常称为气体的标准状况,试求甲烷在标准状况下的密度。
解:低压下甲烷可视为理想气体,由理想气体状态方程pV=nRT,可得
p=nRT/V=(m/M)(RT/V)=ρRT/M
所以
ρ=pM/(RT)=[101325×16.042×10-3/(8.314×273.15)]kg·m-3=0.716kg·m-3
内容来源
天津大学物理化学教研室《物理化学》(第6版)笔记和课后答案

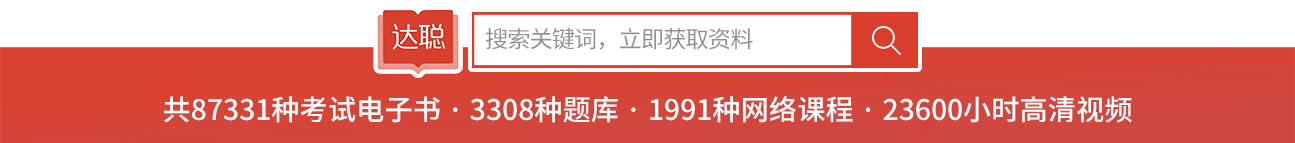
1-4 两个容积均为V的玻璃球泡之间用细管连接,泡内密封着标准状况下的空气。若将其中一个球加热到100℃,另一个球维持0℃,忽略连接细管中气体体积。试求该容器内空气的压力。
解:由题意可知:(1)系统物质的量总量恒定;(2)两球中压力相等。
设标准状态下p1=101.325kPa,开始温度T1=273.15K,T2=373.15K。
由质量守恒得:n=2p1V/(RT1)=n1+n2=p2V/(RT2)+p2V/(RT1)
所以
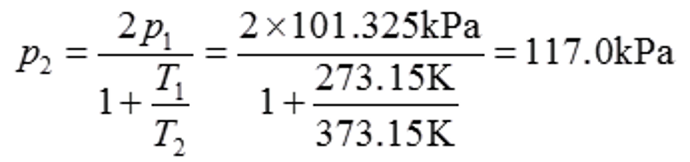
1-5 0℃时氯甲烷(CH3Cl)气体的密度ρ随压力p的变化如下
表1-2-1

试由ρ/p-p关系求CH3Cl的相对分子质量。
解:由理想气体状态方程可得
p=nRT/V=(m/M)(RT/V)=ρRT/M
真实气体在一定温度下,压力越低越接近理想气体,故只有在压力趋向于0的时候上式才成立,![]() 。
。
由题给数据计算ρ/p值,见表1-2-2。
表1-2-2

利用表1-2-2中的数据作ρ/p-p图,如图1-2-1所示,将直线外推到p=0,可得:ρ/p=0.022236g·dm-3/kPa,所以
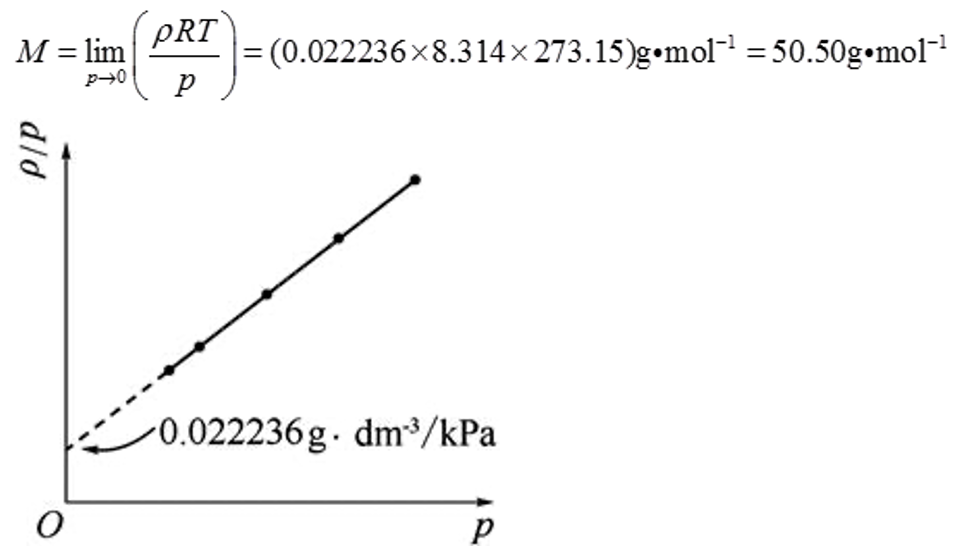
图1-2-1
1-6 今有20℃的乙烷-丁烷混合气体,充入一个抽成真空的200cm3容器中,直至压力达到101.325kPa,测得容器中混合气体的质量为0.3897g。试求该混合气体中两种组分的摩尔分数及分压力。
解:假设两种气体均为理想气体,则两种气体总的物质的量为
n=pV/RT=[101.325×103×200×10-6/(8.3145×293.15)]mol=0.008315mol
又M乙=30.07g·mol-1,M丁=58.12g·mol-1,
且
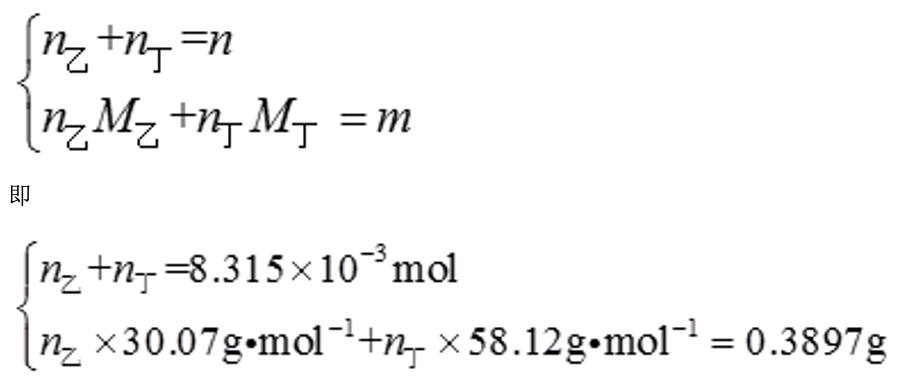
由以上方程解得n乙=3.335×10-3mol,n丁=4.980×10-3mol。
所以
y乙=n乙/(n乙+n丁)=3.335×10-3/(3.335×10-3+4.980×10-3)=0.4011
y丁=1-y乙=1-0.4011=0.5989
p乙=y乙·p=(0.4011×101.325)kPa=40.641kPa
p丁=p-p乙=(101.325-40.641)kPa=60.684kPa
【完整版】 达聪网 天津大学物理化学教研室《物理化学》(第6版)笔记和课后习题(含考研真题)详解
热门内容
天津大学物理化学教研室《物理化学》(第6版)(上册)配套题库【考研真题精选+章节题库】
天津大学物理化学教研室《物理化学》(第6版)(下册)配套题库【考研真题精选+章节题库】
天津大学物理化学教研室《物理化学》(第6版)全套资料【笔记+题库】